Sociedad -
INVESTIGACIÓN
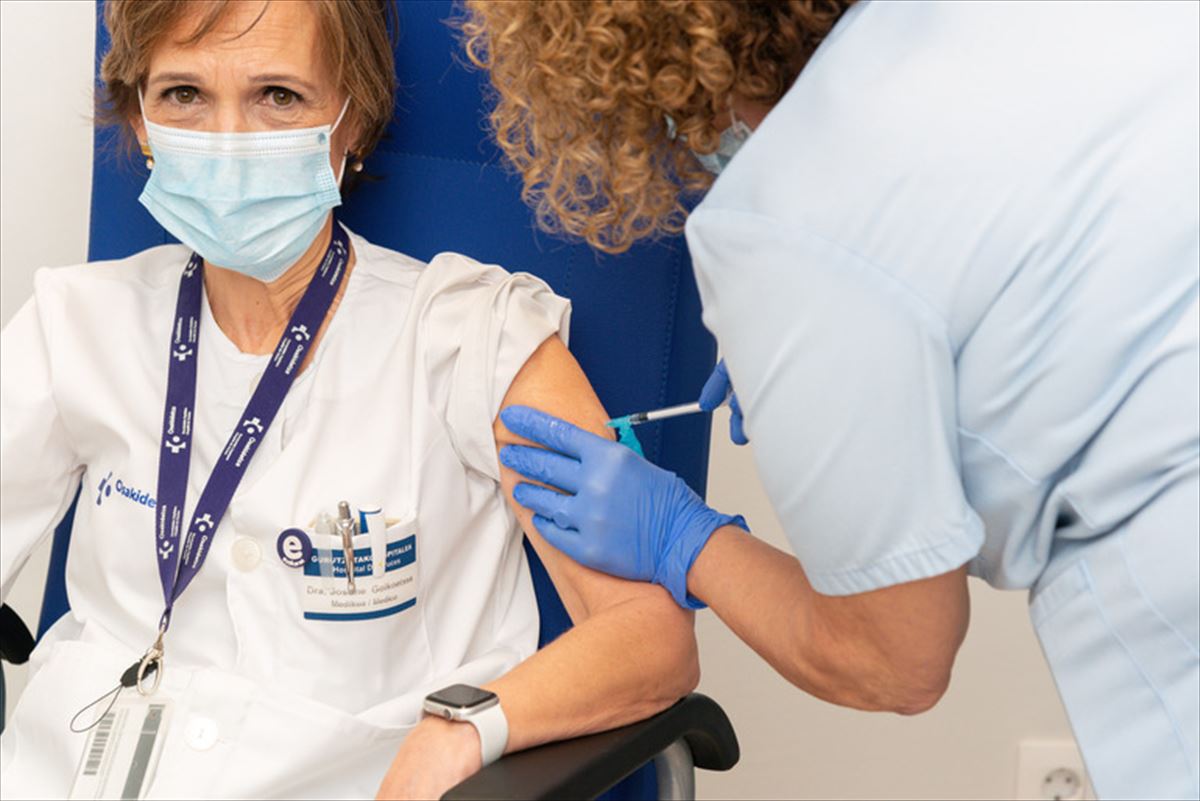
La CAV participará en el ensayo clínico de la vacuna de la farmacéutica Curevac
Los institutos de Investigación Sanitaria Biodonostia y Biocruces Bizkaia han sido seleccionados para participar en el ensayo. La CAV podría aportar hasta 2000 participantes.
EITB MEDIA
Euskaraz irakurri: EAEk Curevac farmazia-enpresaren txertoaren saiakuntza klinikoan parte hartuko du
Los institutos de Investigación Sanitaria Biodonostia y Biocruces Bizkaia de Osakidetza han sido seleccionados para participar en el ensayo clínico que probará la efectividad y la seguridad de la vacuna contra la covid-19 desarrollada y promovida por la farmacéutica alemana Curevac.
La CAV aporta dos de los tres centros seleccionados a nivel estatal para la investigación, el tercero pertenece a la comunidad de Madrid. Se trata de un ensayo clínico de gran magnitud en el que están siendo incluidos más de 30 000 participantes en todo el mundo de los cuales, la Euskadi podría aportar hasta 2000 de ellos.
La empresa biofarmacéutica alemana Curevac ha desarrollado una vacuna basada en el mecanismo del RNA mensajero que estimula el sistema inmunitario; es decir, el mismo que emplean las vacunas de Pfizer y Moderna. Sin embargo, Curevac supera uno de los principales obstáculospara la utilización de las vacunas ya comercializadas ya que sus condiciones de mantenimiento y preparación facilitan la logística de distribución.
Además, al producirse en Europa, se trata de una de las vacunas que más dosis ha comprometido para su distribución en los países de nuestro ámbito.
Participación
Todas las personas de la CAV mayores de 18 años y que cumplan los criterios señalados en el protocolo del estudio podrán participar en el mismo de forma voluntaria.
El ensayo requiere dos dosis de vacuna administrados con 28 días de margen. Las personas que participen serán distribuidas de manera aleatoria en el grupo que recibe la vacuna o en un grupo control que recibe un placebo (un compuesto que no tiene ningún efecto).
Las participantes recibirán un seguimiento de hasta un año con visitas médicas y llamadas telefónicas, además del acceso a una aplicación móvil que facilitará el registro de información. Podrán solicitar salir del estudio en cualquier momento y conocer si recibieron vacuna o placebo.
A los tres y seis meses se realizarán análisis intermedios que, en función de los resultados, podrían acelerar la aprobación del uso de la vacuna, como ha ocurrido con las comercializadas.
En los próximos días, cuando se disponga de toda la documentación y requerimientos pertinentes, los dos institutos de investigación pondrán en marcha sus procesos de reclutamiento de participantes que serán debidamente comunicados.